FDA chấp thuận sử dụng “tụy nhân tạo” cho bệnh nhân tiểu đường tuýp 1
- thiện tâm
- •
Cục quản lý thực phẩm và dược phẩm Mỹ (FDA) vừa chấp thuận sử dụng một thiết bị “tụy nhân tạo” cho bệnh nhân tiểu đường tuýp 1.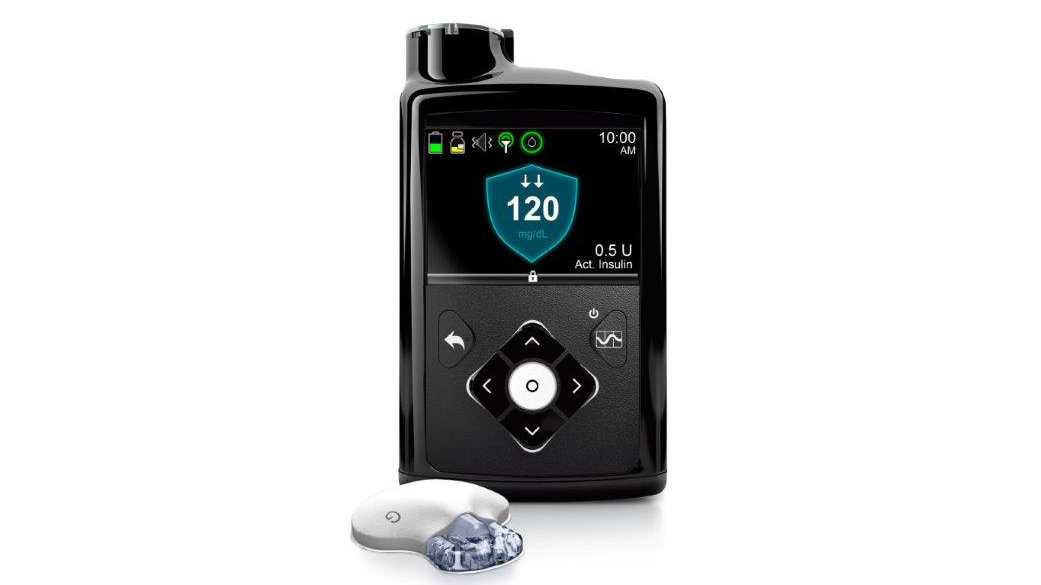
MiniMed 670G là thiết bị mới được sản xuất bởi công ty Medtroni. Nó đã được chấp thuận để sử dụng cho những người bị bệnh tiểu đường tuýp 1 ở độ tuổi trên 14. Thiết bị tự động theo dõi lượng đường trong máu cứ 5 phút/lần và đưa insulin vào cơ thể khi cần thiết, thay thế cho phương pháp xét nghiệm và tiêm thủ công.
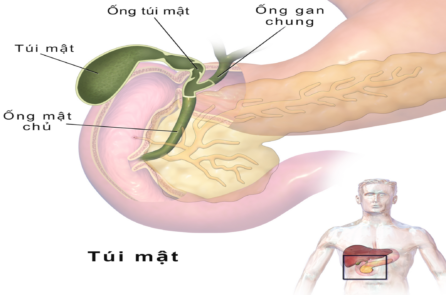
Tiểu đường là tình trạng tăng lượng đường trong máu mãn tính do thiếu Insulin – một hormone giúp người hấp thụ và điều chỉnh lượng đường trong thức ăn. Đặc biệt, tiểu đường tuýp 1 là một bệnh tự miễn, trong đó hệ thống miễn dịch của cơ thể tấn công và tiêu diệt lầm các tế bào tạo ra insulin.
Xem thêm: Phong thủy tốt nhất cho cuộc đời bạn – Kỳ II: Thiện niệm cải biến sức khỏe kỳ diệu
Insulin được sản xuất và cung cấp thông qua tuyến tụy – đó là lý do mà thiết bị được gọi là “tụy nhân tạo”.
Thứ trưởng Bộ Y tế Nguyễn Thanh Long cho biết, sau 10 năm tỷ lệ mắc bệnh tiểu đường ở Việt Nam đã tăng gấp 2 lần từ gần 3% dân số lên đến 5,4%. Ước tính nước ta có khoảng 3 triệu người bệnh.
Những bệnh nhân tiểu đường thường sử dụng một máy bơm insulin để điều chỉnh lượng insulin cần thiết suốt cả ngày. Một số bệnh nhân cũng mua thiết bị giám sát glucose để liên tục theo dõi lượng đường trong máu; nhờ vậy mà có biện pháp khắc phục khi chỉ số quá thấp hoặc quá cao.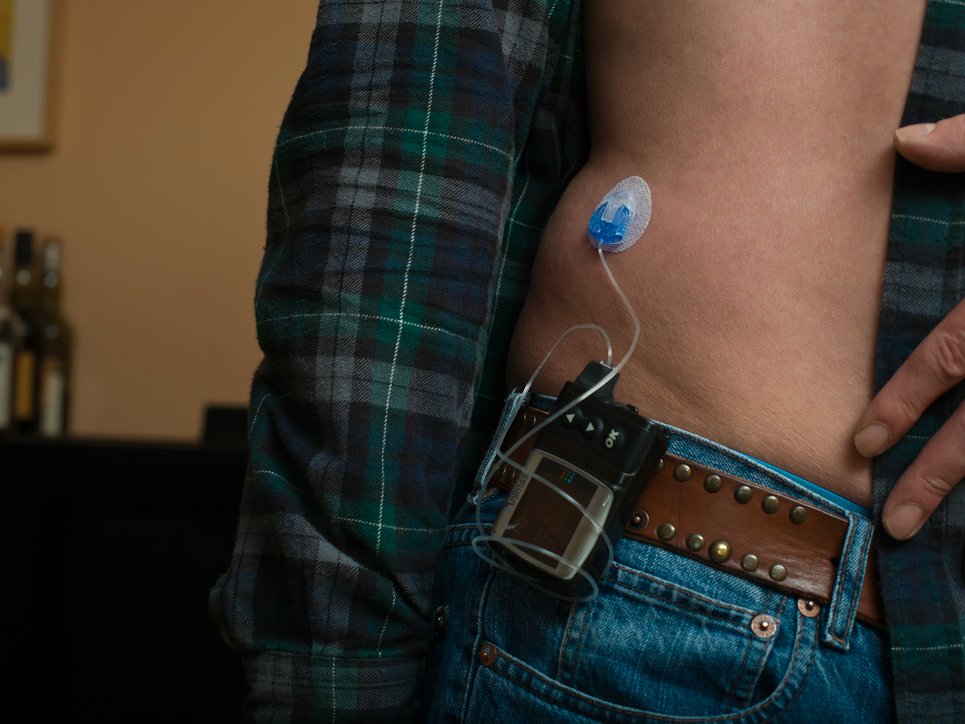
Thiết bị MiniMed 670G kết hợp cả việc giám sát glucose và bơm insulin trong cùng một nơi. “Đây là công nghệ mới độc nhất” được chấp thuận đưa vào sử dụng, theo nhận xét của Jeffrey Shoorin, nhân viên FDA.
Theo FDA, MiniMed 670G sẽ đo đường huyết năm phút một lần, sau đó điều chỉnh bằng cách gửi thêm insulin vào cơ thể, hoặc giữ ổn định. Thiết bị còn có tính năng cho phép bệnh nhân thao tác bằng tay để nhập thêm insulin trong khoảng thời gian các bữa ăn.
Thử nghiệm lâm sàng của MiniMed 670G với 123 người mắc bệnh tiểu đường tuýp 1 không gây ra tác dụng phụ nghiêm trọng, mặc dù FDA lưu ý rằng “rủi ro có thể bao gồm hạ đường huyết, tăng đường huyết, cũng như kích ứng da hoặc mẩn đỏ xung quanh đầu truyền tiếp xúc với cơ thể bệnh nhân của thiết bị.”
Sau khi thiết bị được chấp thuận thông qua, Medtronic sẽ làm các xét nghiệm bổ sung để đánh giá hoạt động của thiết bị trong các tình huống thực tế. Công ty cũng đang tiến hành thử nghiệm thêm để biết liệu có thể sử dụng thiết bị cho ở trẻ em từ 7-14 tuổi hay không.
Theo thông tin trên website Medtronic, công ty dự định sẽ bán ra sản phẩm này từ mùa xuân năm 2017. Sản phẩm không dùng cho phụ nữ có thai và người bị suy thận.
Từ khóa FDA phát minh bệnh tiểu đường