FDA thu hồi giấy phép sử dụng khẩn cấp cho vắc-xin COVID-19
- Tú Liên
- •
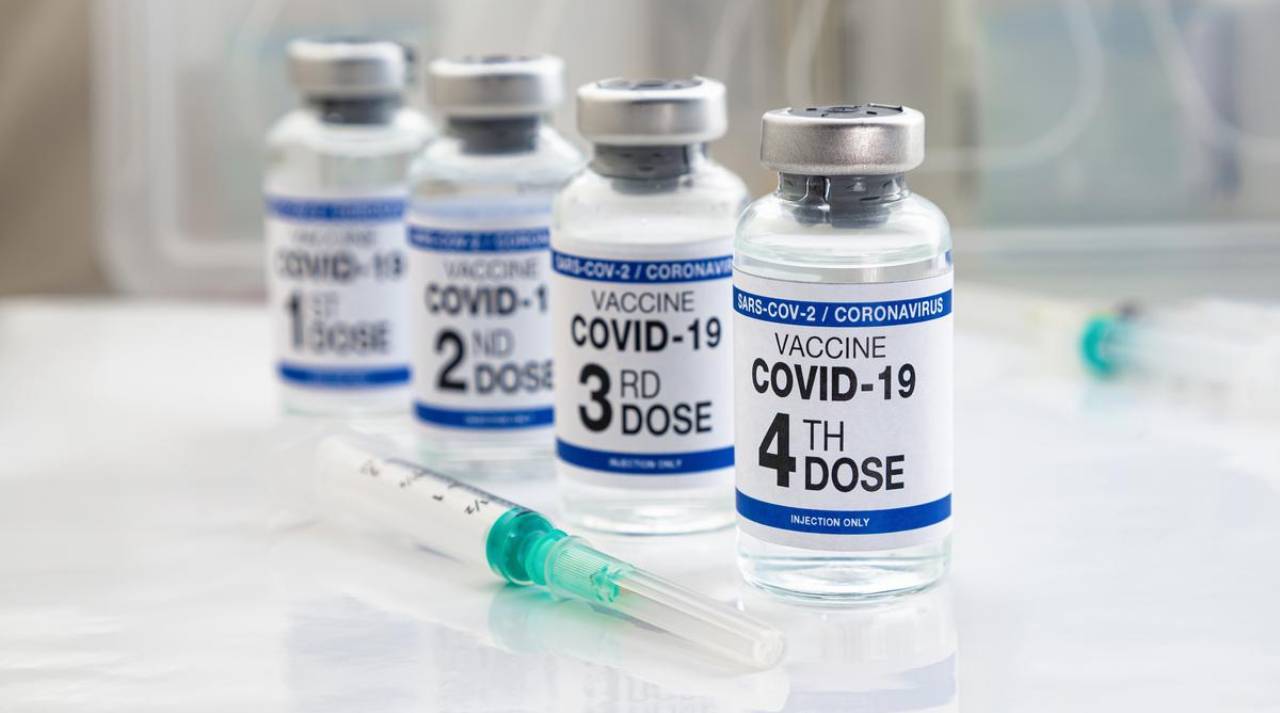
Vào hôm 27/8, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã thu hồi giấy phép sử dụng khẩn cấp (EUA) đối với các vắc-xin COVID-19 của Pfizer-BioNTech, Moderna và Novavax.
EUA là một cơ chế pháp lý đặc biệt, cho phép sử dụng các sản phẩm y tế như thuốc, vắc-xin hay thiết bị y tế trong các tình huống khẩn cấp về sức khỏe cộng đồng. Cơ chế này được áp dụng khi chưa có đủ dữ liệu để phê duyệt chính thức, nhưng các chuyên gia y tế tin rằng sản phẩm có thể hiệu quả và lợi ích vượt trội so với rủi ro.
FDA lần đầu cấp EUA cho các vắc-xin COVID-19 vào cuối năm 2020, dựa trên tình trạng khẩn cấp và thiếu sản phẩm đã được chấp thuận để phòng ngừa căn bệnh này.
Mặc dù EUA đã bị thu hồi, các vắc-xin này vẫn được phép sử dụng cho một số nhóm đối tượng theo các chỉ định đã được FDA phê duyệt:
- Moderna COVID-19 Vaccine: Vẫn được phê duyệt sử dụng cho người từ 6 tháng tuổi trở lên.
- Pfizer-BioNTech COVID-19 Vaccine: Vẫn được phê duyệt cho người từ 5 tuổi trở lên có ít nhất một yếu tố nguy cơ làm tăng khả năng mắc COVID-19 nghiêm trọng.
- Novavax COVID-19 Vaccine, Adjuvanted: Vẫn được phê duyệt cho người từ 12 tuổi trở lên có ít nhất một yếu tố nguy cơ làm tăng khả năng mắc COVID-19 nghiêm trọng.
Các phê duyệt lần này khác với các phê duyệt trước đây. Trước đây việc chỉ định tiêm vắc-xin không bị hạn chế với bất kỳ nhóm dân số nào, ngoại trừ trẻ sơ sinh dưới 6 tháng tuổi. Hành động này của FDA tương đương với việc vắc-xin sẽ không còn được áp dụng cho khoảng 240 triệu người Mỹ.
Tú Liên
Từ khóa Vắc xin COVID-19